本博客为清华大学“工程热力学”课程的复习笔记(持续更新中)。
第一章 基本概念
热力系统
热力系统:人为选取的一定范围内的物质
外界:系统意外的所有物质
边界:系统与外界的分界面
系统与外界的作用都通过边界
| 出口 | 有 | 无 |
|---|---|---|
| 是否传质 | 开口系 | 闭口系 |
| 是否传热 | 非绝热系 | 绝热系 |
| 是否传功 | 非绝功系 | 绝功系 |
| 是否传热、功、质 | 非孤立系 | 孤立系 |
简单可压缩系统:只交换热量及准静态容积变化功
状态和状态参数
状态:某一瞬间热力系所呈现的宏观状况
状态参数:描述热力系状态的宏观物理量
- 状态参数的特征:单值性
强度参数:与物质的量无关的参数
如压力 $p$ 、温度 $T$
广延参数:与物质的量有关的参数,具有可加性,如质量 $m$ 、容积 $V$ 、内能 $U$ 、焓 $H$ 、熵 $S$
比参数:具有强度参数的性质 eg. 比容 $v = \frac{V}{m}$
基本状态参数:压力 $p$,温度 $T$,比容 $v$。
压力
常用单位:
绝对压力与环境压力的相对值 —— 相对压力
注意: 只有绝对压力 $p$ 才是状态参数
绝对压力与相对压力
当 $p > p_b$ :表压力 $p_g$ (Gauge pressure),$p = p_b + p_g$
当 $p < p_b$ :真空度 $p_v$ (Vacuum pressure),$p = p_b - p_v$
(其中 $p$ 为绝对压力, $p_b$ 为环境压力)
温度
温度 $T$ 的一般概念:
- 传统:冷热程度的度量(感觉,导热介质等有关)
- 微观:衡量分子平均动能的量度
热力学第零定律:如果两个系统分别与第三个系统处于热平衡,则两个系统彼此必然处于热平衡。
处于同一热平衡状态的各热力系,必定有某一宏观特征彼此相同,用于描述该宏观特征的物理量——温度
比容
表示工质聚集的疏密程度
物理中常用密度 $\rho$
平衡状态
平衡的本质:不存在不平衡势差
准静态过程与可逆过程
准静态过程
系统随时接近于某个平衡态
准静态过程的工程条件:
破坏平衡所需时间(外部作用时间) $\gg$ 自行恢复平衡所需时间(驰豫时间)
能够足够快恢复到新平衡 $\rightarrow$ 准静态过程
变化过程中的任一时刻的状态都是确定的,即可以用状态参数描述。
准静态过程的容积变化功:
$m$ kg工质发生容积变化对外界作的功:
$1$ kg工质对外界作的功:
功的大小与路径有关,是过程量
可逆过程
一般定义:系统经历某一过程后,如果能使系统与外界同时恢复到初始状态,而不留下任何痕迹,则此过程称为可逆过程。
准静态过程 + 无耗散效应 = 可逆过程
功量
功的力学定义: 力 $\times$ 在力方向上的位移
功的热力学定义:功是系统与外界相互作用的一种方式,是在力的推动下,通过有序运动方式传递的能量。
功的一般表达式:
热力学中常见的功:
准静态定容积变化功 膨胀功 (+) or 压缩功 (-)
热量与熵
定义:
热量是热力系与外界相互作用的另一种方式,是在温差的推动下,以微观无序运动方式传递的能量。
热量与容积变化功
| 能量传递方式 | 容积变化功 | 热量 |
|---|---|---|
| 性质 | 过程量 | 过程量 |
| 推动力 | 无限小 $p$ 势差 | 无限小 $T$ 势差 |
| 标志 | $\mathrm dV,\mathrm dv$ | $\mathrm dS, \mathrm ds$ |
| 表达式 | $\delta w = p\mathrm dv$ | $\delta q = T\mathrm ds$ |
| $w = \int p\mathrm dv$ | $q = \int T\mathrm ds$ | |
| 适用条件 | 准静态或可逆 | 可逆 |
熵 (Entropy) 的定义:
广延量 $\text{kJ/K}$
比参数 $\text{kJ/(kg.K)}$
$\mathrm{d} s$: 可逆过程 $\delta q_{\text{rev}}$ 除以传热时的 $T$ 所得的熵
熵的说明:
- 熵是状态参数
- 符号规定:
系统吸热时为正,$Q > 0$,$dS > 0$
系统放热时为负,$Q < 0$,$dS < 0$ - 熵的物理意义:熵变可以体现可逆过程传热的大小与方向
- 用途:判断热量传递方向,计算可逆过程的传热量
热力循环
定义: 工质经过一系列变化回到初态,这一系列的变化过程称为热力循环。
热力循环的评价指标
正循环:净效应(吸热,对外作功)
动力循环:热效率
逆循环:净效应(对内作功,放热)
制冷循环:制冷系数
制热循环:制热系数
第二章 热力学第一定律
热力学第一定律的本质
本质:能量转换与守恒。
闭口系循环的热力学第一定律表达式:
热力学第一定律又可表述为:第一类永动机是不可能制成的
热力学第一定律的推论——内能
内能及闭口系热一律表达式
定义 $\mathrm d U = \delta Q - \delta W$,内能 $U$ 是状态参数
闭口系热一律表达式:
内能 $U$ 的物理意义
$\mathrm d U$ 代表某微元过程中系统通过边界交换的微热量与微功量之差值,也即系统内部能量的变化。
$U$ 代表储存于系统内部的能量——内储存能(内能,热力学能)
内能的说明
内能是状态参数 (state property)
$U$:广延参数 $\text{[kJ]}$
$u$:比参数 $\text{[kJ/kg]}$
内能总以变化量出现,其零点可人为确定
系统总能
外部储存能
- 宏观动能 $ E_k = mc^2 / 2$
- 重力位能 $ E_p = mgz$
系统总能 (=内能+动能+位能)
热一律的文字表达式
热一律: 能量守恒与转换定律
闭口系能量方程
一般式:
单位质量工质
适用条件: 1) 任何工质 2) 任何过程
注意:
- 状态量——微分符号 $\mathrm d$
- 过程量——微小变化符号 $\delta$
准静态过程及可逆过程能量方程
简单可压缩系准静态过程:
简单可压缩系可逆过程:
开口系能量方程与焓
推进功 的表达式
推进功(流动功、推动功):工质进、出开口系而传递的功
注意:不是 $p \mathrm d v$,v 无变化。
对推进功的说明:
- 与宏观流动有关,流动停止,推进功不存在
- 作用过程中,工质仅发生位置变化,无状态变化
- $w_{推}$ 与所处状态有关,是状态量
- 并非工质本身能量(动能、位能)变化引起,而由外界(泵或风机)做出,流动工质所携带的能量
可理解为:由于工质的进出,系统与外界交换的一种机械功,表现为流动工质进出系统使所携带或所传递的一种能量。
开口系能量方程的推导
热一律: 进入系统的能量-离开系统的能量=系统总能的变化
其中 $W_{net}$ 为净功,$\mathrm d E_{cv}$ 为控制体($\text{control volume}$)总能量的变化。
开口系能量方程通用式及焓的引入
定义:焓 $h = u + pv$
焓 Enthalpy 的说明:
定义:
焓是状态量 (state property)
$H$ 为广延参数:
$h$ 为比参数
对流动工质,焓代表能量(内能 + 推进功)
对静止工质,焓不代表能量物理意义:
开口系中随工质流动而携带的能量,取决于热力状态的能量。
稳定流动能量方程与技术功
稳定流动的条件
稳定流动能量方程的推导
稳定流动能量方程,适用于任何工质稳定流动过程。
技术功 Technical work
$W_t$(动能,位能,轴功)$\rightarrow$ 机械能,工程技术上可以直接利用
稳定流动过程中几种功的关系
闭口系 $ q = \Delta u + w $(容积变化功) 等价于
稳流开口系 $ q = \Delta h + w_t $(技术功)
简单可压缩系统准静态过程技术功
准静态过程技术功在示功图上的表示
技术功为膨胀功与推进功差值的代数和
$\mathrm d p < 0$ 压力降低, $w_t > 0$ 对外作功
稳定流动能量方程的应用
动力机械 能量方程
1) 体积不大
2) 流速差不大: $q = \Delta h + w_s$
3) 时间短、保温: $q \approx 0$
$w_s = -\Delta h = h_1 - h_2 > 0$, 输出的轴功是靠焓降转变而来的。
压缩机械 能量方程
1) 体积不大
2) 流速差不大: $q = \Delta h + w_s$
3) 保温层: $q \approx 0$
$w_s = -\Delta h = h_1 - h_2 < 0$,输入的轴功转变为焓升
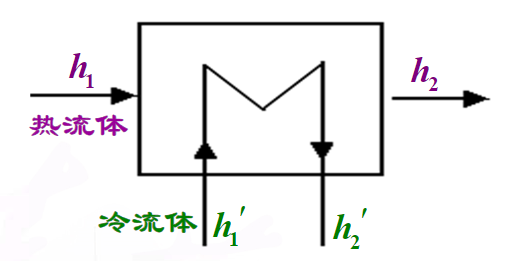
换热设备 能量方程
$q = \Delta h + w_s$。无作用部件,$w_s = 0$
$\Rightarrow q = \Delta h = h_2 - h_1$
焓变:
- 热流体放热:$q = \Delta h = h_2 - h_1 < 0$
- 冷流体吸热:$q’ = \Delta h = h_1’ - h_2’ > 0$
绝热节流 能量方程
$q = \Delta h + w_s$, 绝热: $q = 0$
没有作用部件: $w_s = 0$
在忽略动、位能变化的绝热节流过程中,节流前后的工质焓值相等。但需注意,由于在上、下游截面之间,特别在缩口附近,流速变化很大,焓值并不处处相等,即不能把此绝热节流过程理解为定焓过程。
第三章 理想气体的性质与过程
理想气体模型
1. 分子间无相互作用力。(只有弹性碰撞力)
2. 分子本身不占容积。(质点)
实际气体,当其 $p$ 很小, $v$ 很大, $T$ 不太低时, 即处于远离液态的稀薄状态时, 可视为理想气体。
三原子分子 $(H_2O, CO_2)$ 一般不能当作理想气体。 特殊情况可以,如空调的湿空气,高温烟气的 $CO_2$
一般:$T \geq$ 常温,$p < 7 \text{ MPa}$ 的双原子分子 $\Rightarrow$。(eg. $O_2, N_2, \text{Air}, CO_2, H_2$)
理想气体状态方程
理想气体定义: 遵循克拉贝龙状态方程的气体。
克拉贝龙状态方程的四种形式:
注意: 1) $R_m$ 与 $R$ 2) 摩尔容积 $V_m$ 3) 统一单位
$R_m$ 与 $R$ 的区别
$R_m$ —— 通用气体常数
- 与气体种类无关
$R$ —— 气体常数
- 与气体种类有关
- $M$ —— 摩尔质量
例如:
比热容
比热容的定义:
单位物量的物质升高 $1K$ 或 $1 ^\circ\text{C}$ 所需的热量
各种比热容:
$c$: 质量比热容
$C_m$: 摩尔比热容
$C’$: 容积比热容
比热容是过程量。
常用某些特定过程的比热容:$
\begin{cases}
定容比热容 \\
定压比热容
\end{cases}
$
定容比热容 $c_v$
准静态过程 $\delta q = du + p dv$,$u$ 是状态量,设 $u = f(T, v)$:
因此:
定容条件下:
定压比热容 $c_p$
准静态过程 $\delta q = dh - v dp$,$h$ 是状态量,设 $h = f(T, p)$
因此:
定压条件下:
$c_v$ 和 $c_p$ 的说明
$c_v$ 和 $c_p$ 是状态量
$c_v$ 物理意义:$\mathbf{v}$ 不变时 $1 \, kg$ 工质温升 $1K$ 内能的增加量
$c_p$ 物理意义:$\mathbf{p}$ 不变时 $1 \, kg$ 工质温升 $1K$ 焓的增加量前面的推导没有用到理想气体性质,适用于任何气体。
$h$、$u$ 的计算要用 $c_v$ 和 $c_p$
理想气体的内能、焓、熵和比热容
理想气体的内能
$u = f(T)$,理想气体 $u$ 只与 $T$ 有关
实际气体:
理想气体:
对理想气体,任何过程都成立
理想气体的焓
理想气体 $h$ 只与 $T$ 有关。
实际气体:
理想气体:
因此:
对理想气体,任何过程都成立
理想气体的熵
熵的定义: $\mathrm{d}s = \frac{\delta q_{\text{rev}}}{T}$
可逆过程
因此:
理想气体满足:
因此,
理想气体的 $c_v$ 和 $c_p$ 的关系
一般工质:
理想气体:
因此:
迈耶公式:
令:
则:
由于理想气体的内能,焓都只是温度的单值函数,理想气体的定压、定容比热容也只是温度的单值函数,甚至可能是定值。
通常只会在温度不太高、温度范围比较窄,且计算精度要求不高的情况下,或者为了分析问题方便,才将摩尔热容近似地看作定值。
实际上分子内部还存在振动,而且分子转动与振动的能量与温度并不是线性关系,因此理想气体热容并非定值,而是温度的单值函数。
理想气体比热容、内能、焓和熵的计算
$u$、$h$、$s$ 的计算要用 $c_v$ 和 $c_p$
理想气体比热容的计算方法:
按定比热计算:
由分子运动学:
| 单原子 | 双原子 | 多原子 | |
|---|---|---|---|
| $C_{v,m}$ (kJ/(kmol·K)) | $\dfrac{3}{2} R_m$ | $\dfrac{5}{2} R_m$ | $\dfrac{7}{2} R_m$ |
| $C_{p,m}$ (kJ/(kmol·K)) | $\dfrac{5}{2} R_m$ | $\dfrac{7}{2} R_m$ | $\dfrac{9}{2} R_m$ |
| $k$ (比热比) | $1.67$ | $1.4 $ | $1.29 $ |
按真实比热计算:
理想气体
根据实验结果整理:
按平均比热计算:
理想气体 $\Delta u$ 的计算
- $c_v = \text{Const}$
- $c_v$ 为真实比热
- $c_v$ 为平均比热
- 若为空气,可直接查附表2:
理想气体 $\Delta h$ 的计算
- $c_p = \text{Const}$
- $c_p$ 为真实比热
- $c_p$ 为平均比热
- 若为空气,可直接查附表2:
理想气体 $\Delta s$ 的计算
理想气体,任何过程
定比热(常用)
理想气体的等熵过程
绝热过程未必是等熵过程,只有可逆绝热过程才是等熵过程。
不仅 $\Delta s = 0$,而且 $\mathrm{d}s = 0 \longrightarrow s$ 处处相等。
理想气体
当 $k = \text{const}$ 时:
即为可逆绝热系统的过程方程
需要满足三个条件:
- 理想气体
- 等熵过程
- $k$ (比热比,绝热指数)为常数
理想气体绝热过程的过程方程
理想气体绝热过程 $w$, $w_t$, $q$ 的计算
容积变化功:
对于定比热容理想气体的可逆绝热过程,利用 $p v^k = \text{const}$ :
技术功:
可逆绝热时有:
热量:
理想气体热力过程综合分析
多变过程与基本过程
$n$ 是常量,每一个多变过程 $n$ 为定值
例:$n = k \quad \longrightarrow \quad$ 等熵过程
理想气体多变过程 $w$, $w_t$, $q$ 的计算
$p v^n = \text{Const}$
$c_n$ 为多变比热容
多变过程与基本过程的关系
基本过程是多变过程的特例。
当 $n = 0$: (等压过程)
当 $n = 1$: (等温过程)
当 $n = k$: (等熵过程)
当 $n = \infty$: (等容过程)
理想气体基本过程的计算
气体的各种热力过程:
| 过程 | 过程方程式 | 初、终状态参数间的关系 | 功量交换 $w$ (J/kg) | 功量交换 $w_t$ | 热量交换 $q$ (J/kg) |
|---|---|---|---|---|---|
| 定容 | $v = \text{定数}$ | $v_2 = v_1$ , $\dfrac{T_2}{T_1} = \dfrac{p_2}{p_1}$ | $0$ | $v(p_1 - p_2)$ | $c_v (T_2 - T_1)$ |
| 定压 | $p = \text{定数}$ | $p_2 = p_1$ , $\dfrac{T_2}{T_1} = \dfrac{v_2}{v_1}$ | $p(v_2 - v_1)$ 或 $R(T_2 - T_1)$ | $0$ | $c_p (T_2 - T_1)$ |
| 定温 | $pv = \text{定数}$ | $T_2 = T_1$, $\dfrac{p_2}{p_1} = \dfrac{v_1}{v_2}$ | $p_1 v_1 \ln \dfrac{v_2}{v_1}$ | $w$ | $w$ |
| 绝热 | $pv^k = \text{定数}$ | $\dfrac{p_2}{p_1} = \left( \dfrac{v_1}{v_2} \right)^k$ $\dfrac{T_2}{T_1} = \left( \dfrac{v_1}{v_2} \right)^{k-1}$ |
$\dfrac{p_1 v_1 - p_2 v_2}{k - 1}$ 或 $\dfrac{R}{k - 1} (T_1 - T_2)$ |
$kw$ | $0$ |
| 多变 | $pv^n = \text{定数}$ | $\dfrac{p_2}{p_1} = \left( \dfrac{v_1}{v_2} \right)^n$ $\dfrac{T_2}{T_1} = \left( \dfrac{v_1}{v_2} \right)^{n-1}$ |
$\dfrac{p_1 v_1 - p_2 v_2}{n - 1}$ 或 $\dfrac{R}{n - 1} (T_1 - T_2)$ |
$nw^{\circ}$ | $c_n (T_2 - T_1)$ $= \left( c_v - \dfrac{R}{n - 1} \right)$ $\times (T_2 - T_1)$ |
气体的压缩
压气机的作用:
- 生活中:自行车打气。
- 工业上:锅炉鼓风、出口引风、燃气轮机、制冷空调等
结构形式:
- 活塞式(往复式),视为连续流动
- (离心式、涡旋)、(轴流式、螺杆):连续流动
压力范围:
- 通风机 $\Delta p < 0.01 \text{ MPa}$
- 鼓风机 $0.01 \text{ MPa} < \Delta p < 0.3 \text{ MPa}$
- 压缩机 $\Delta p > 0.3 \text{ MPa}$
活塞式压气机压缩过程分析
目的:研究耗功,耗功最小
理论压气功:可逆过程中压送气体消耗的技术功 $w_t$
可能的压气过程
- 特别快,来不及换热:绝热过程 $\quad n = k$
- 特别慢,热量全部散失:等温过程 $\quad n = 1$
- 一般压气过程:$n$ 不变 $\quad 1 < n < k$
三种压气过程参数的比较
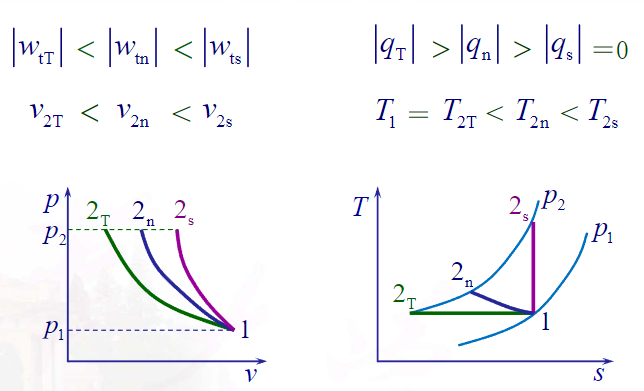
三种压气过程的技术功
最佳增压比的推导
其中,$T1 = T3, \; p_2 = p_3$
求 $w_{\text{分级}}$ 的最小值:$\dfrac{\partial w_{\text{分级}}}{\partial p_2} = 0$
最佳增压比:
若为 $m$ 级,则
分级压缩的级数
分级的作用:1. 省功 2. 降低出口温度
多级压缩达到无穷多级 $\quad \Rightarrow \quad$ 等温过程。(缺点:难以实现、结构复杂(成本高))
一般采用 $2 \sim 4$ 级压缩
第四章 热力学第二定律
热力学第二律的表述与实质
开尔文-普朗克表述:热功转换角度
克劳修斯表述:热量传递角度
开尔文-普朗克表述
不可能从单一热源取热,并使之完全转变为有用功而不产生其它影响。 热机不可能将从热源吸收的热量全部转变为有用功,而必须将其中的一部分传给冷源。
理想气体等温过程 $q = w$ ?气体膨胀,产生其他影响。
热源/冷源的特点:容量无限大,吸热或放热,其温度不变。
第二类永动机:从单一热源取热,并使之完全变为功的热机。由热力学第二定律可以知道,第二类永动机是不可能制造成功的。
克劳修斯表述
不可能将热从低温物体传至高温物体而不引起其它变化。
空调的制冷与制热? 代价:耗功
热量不可能自发地、不付代价地从低温物体传至高温物体。
热力学第二定律的实质
自发过程都是具有方向性的
卡诺定理与卡诺循环
卡诺定理
定理:在两个不同温度的恒温热源间工作的所有热机,可逆热机的热效率最高。
即在恒温 $T_1$ 与 $T_2$ 下,$n_{t, A} \not > n_{t, R}$
卡诺定理的推论
在两个不同温度的恒温热源间工作的一切可逆热机具有相同的热效率,且与工质的性质无关。
在两个不同温度的恒温热源间工作的任何不可逆热机,其热效率总小于这两个热源间工作的可逆热机的热效率。
卡诺循环——理想可逆热机循环
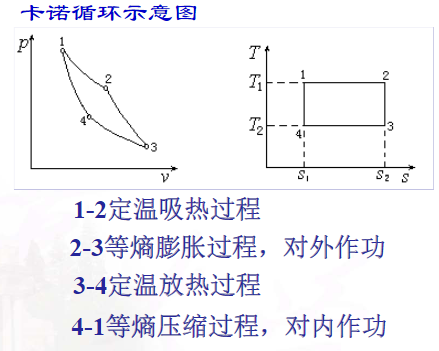
卡诺热机循环的热效率
热机热效率:$\eta_t = \dfrac{w}{q_1} = \dfrac{q_1 - q_2}{q_1} = 1 - \dfrac{q_2}{q_1}$
卡诺定理推论:$T_1$ 与 $T_2$ 间的一切可逆热机,热效率相同,与工质性质无关。
对于卡诺热机循环,取理想气体为工质,其可逆定温过程的吸热量 $q_1$ 和放热量 $q_2$:
而对于 $2 - 3$ 及 $4 - 1$ 等熵过程,
所以,
卡诺热机循环热效率:
卡诺热机循环热效率的说明
$\eta_{t, c}$ 只取决于恒温热源的温度 $T_1$ 和 $T_2$,而与工质的性质无关;
$T_1 \uparrow$ 或 $T_2 \downarrow$ 时,$\eta_{t, c} \uparrow$,即温差越大,$\eta_{t, c}$ 越高
$T_1 \neq \infty \, \text{K}$,$T_2 \neq 0 \, \text{K}$,∴ $\eta_{t, c} < 100\%$,符合热力学第二定律
当 $T_1 = T_2$,$\eta_{t, c} = 0$,单热源热机不可能
卡诺逆循环
- 卡诺制冷循环
- 卡诺制热循环
多热源(变温热源)可逆热机
因此 $\eta_{t R\text{多}} < \eta_{t C}$
平均温度法: $T_1$ 与 $T_2$ 间的卡诺循环 $\eta_{t R\text{多}} = 1 - \dfrac{\overline{T_2}}{\overline{T_1}}$
概括性卡诺循环
用两个多变过程取代可逆绝热过程,吸热和放热的多变指数 $n$ 相同。
完全回热:$Q_{da} = -Q_{bc}$
提供了提高热效率的一个途径:回热
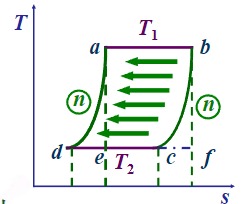
关于热机热效率的小结
在两个恒温热源 $T_1$, $T_2$ 间工作的一切可逆热机,$\eta_R = \eta_C$,与工质性质无关。
多(变温)热源间工作的可逆热机 $\eta_{R\text{多}} <$ 同温限间工作卡诺热机 $\eta_C$
不可逆热机 $\eta_{IR} <$ 同热源间工作可逆热机 $\eta_R$
因此在给定温度界限间工作的一切热机,$\eta_C$ 最高 $\Longrightarrow$ 热机极限
实际热机与卡诺热机
卡诺热机只有理论意义,是理想极限。实际上等温过程和绝热过程很难实现。
克劳修斯不等式及熵的引出
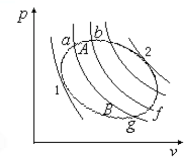
对于任意可逆循环,如用无数组绝热线将其分割,微元循环 $\text{abfga}$ 可近似看成微卡诺循环。
因此,对任意循环,有克劳修斯不等式:
<不可逆循环=可逆循环>不可能
是热力学第二定律表达式之一
熵的引出以及物理意义
定义:
熵
比熵
$T$:热源温度 $=$ 工质温度
熵的物理意义之一:熵变可以体现可逆过程热交换的方向和大小
熵变及熵的循环积分
熵是状态量,熵变与路径无关,只与初终态有关
熵的环积分:
不可逆过程熵的变化
熵变与传热量及熵流与熵产
任意不可逆循环
而
因此
不可逆绝热过程:$\delta Q = 0$,$\Delta S > 0$
除了传热,还有其它因素影响熵 $\Rightarrow$ 不可逆因素会引起熵变
熵流和熵产
熵流:$\mathrm{d}S_f = \dfrac{\delta Q}{T_r}$ 由热流进、出系统引起的
熵产:由不可逆因素引起的。永远有 $\mathrm{d}S_g > 0$
热力学第二定律表达式之一
熵产是过程不可逆性程度的度量
熵变的计算
1. 理想气体
a. 初、终态
b. 定义式
2. 非理想气体 :查图表
3. 固体和液体
$\mathrm{d}S = \dfrac{\delta Q_{\text{re}}}{T} \qquad$ 熵变与过程无关
而
通常 $c_p = c_v = c$ 为常数,例:水 $c = 4.1868 \, \text{kJ/(kg} \cdot \text{K)}$
4. 热源(蓄热器)
与外界交换热量,$T$ 始终不变
热源 $T1$ 的熵变:
5. 功源(蓄功器) :只与外界交换功
可以设想为理想弹簧:无耗散,无热量交换
功源的熵变: $\Delta S = 0$
孤立系统熵增原理
孤立系统熵增原理
孤立系统 $=$ 非孤立系统 $+$ 相关外界
孤立系统的熵只能增大,或者不变,绝不能减小。 —— 孤立系统熵增原理
作功能力损失
热量 $Q$ 的量没变,但不可逆过程的熵增,导致作功能力下降,即能量贬值或功的耗散。
作功能力: 以环境为基准, 系统可能作出的最大功。
作功能力损失:
熵方程及对熵的小结
熵方程以及绝热稳流系统熵增原理
闭口系
开口系
稳定流动
绝热稳流系统的熵变:
绝热稳流系统熵增:
熵与不可逆及熵的物理意义
不可逆的深层含义:不可逆, 必然有熵产,必然导致作功能力损失。
熵的物理意义
- 可逆过程传热的大小和方向
孤立系熵增 $\Delta S_{\text{iso}} \geq 0$ 或任何系统的熵产 $\Delta S_g \geq 0$ 表征过程不可逆的程度,熵增越大,表明系统不可逆程度越甚。
自然界有限空间的过程总是朝着孤立系熵增的方向进行,所以熵可以作为过程方向性的判据。
熵的统计意义
$k$:玻尔兹曼常数
$W$:宏观态对应的可能的微观态的数目。
熵可以看作分子无序性或随机性的一种量度,系统越无序,分子所处的位置就越难以预测,熵也就越大。
㶲及其计算
㶲即作功能力
㶲 $\text{Exergy}$: Available Energy 有效能
㷻 $\text{Anergy}$:Unavailable Energy 无效能
㶲的定义:给定环境条件下,能量中最大可能转换为有用功的那部分能量,称为㶲。(㶲即作功能力)
能量中㶲以外的部分是㷻。
热力学第一及第二定律与㶲
热力学第一定律:一切过程,㶲 + 㷻 总量恒定
热力学第二定律:㷻不能转换为㶲
- 可逆过程中,㶲保持不变
- 不可逆过程中,部分㶲退化为㷻
㶲损失、作功能力损失、能量贬值
任何一孤立系,㶲只能不变或减少,不能增加。 —— 孤立系㶲减原理
热量㶲及冷量㶲的计算
1.热量㶲
$Ex_Q$ : 给定环境下,热量 $Q$ 能做的最大有用功。
若是恒温 $T$ 的热量,则:
热量㶲的说明:
$Ex_Q$: $Q$ 中能转换的最大有用功
$Ex_Q = Q - T_0 \Delta S = f(Q, T, T_0)$
- $T_0$, $Q$ 一定,$T \downarrow \Rightarrow Ex_Q \uparrow$
- $T$ 一定,$Q \downarrow \Rightarrow Ex_Q \downarrow$
㶲损失、作功能力损失
单热源热机不能作功
$T = T_0$, $Ex_Q = 0$$Ex_Q$ 是过程量
2.冷量㶲:
冷量㶲:吸热 $Q_2$对外做的最大有用功,或制造冷量 $Q_2$ 时消耗的最小有用功。
实际上,只要系统状态与环境状态有差别,就有可能对外作功,就有㶲。
内能㶲及焓㶲的计算
3.闭口系统内能㶲:
闭口系统内能焓的说明
闭口系的内能 $u_1 - u_0$,只有一部分是 $ex_u$
其余是 $an_u = T_0 (s_1 - s_0) - p_0 (v_1 - v_0)$$ex_u$ 是与工质及环境有关的状态参数
环境的内能很大,但 $ex_u = 0$
闭口系由 $1 \rightarrow 2$ 可逆过程,工质作 最大有用功 或 消耗最小有用功:
4.稳定流动工质的焓㶲:
稳定流动工质焓㶲的说明:
稳流工质的焓 $h_1 - h_0$,只有一部分是 $ex_h$
其余是 $an_h = T_0 (s_1 - s_0)$$ex_h$ 是与工质及环境有关的状态参数
当工质状态与环境相平衡,$ex_h = 0$
由初态 $1 \rightarrow$ 终态 $2$ 的可逆过程,工质作 最大有用功 或 消耗最小有用功:
㶲效率及㶲平衡
㶲平衡:热力系统
㶲效率:
可逆过程:$\eta_{\text{ex}} = 100\%$
- 动力装置
- 动力装置
- 加热设备
㶲损失 $=$ 作功能力损失